
De todos los cationes o aniones, son los que se encuentran mas distribuidos en la naturaleza. Se dividen en:
Se pueden considerar bien diferenciadas 200 especies mineralógicas.
Los minerales que los integran corresponden a sales de ácido sulfúrico y en algunos sulfatos aparecen aniones adicionales:
Am (SO4)p Zq • nH2O => Sal simple.
ABm (SO4)p Zq • nH2O => Sal compuesta.
A y B = Cationes: Na+, K+, Ca2+, Fe2+, Mg2+, en menor proporción sulfatos de metales en relación con yacimientos de oxidación Pb y Cu.
Z = aniones adicionales, sobre todo grupos (OH), y también:
Son compuestos anisodésmicos, que se caracterizan por la presencia de grupos tetraédricos SO4, en este caso aparecen aislados y unidos por una serie de cationes. Se encuentran ocupando lugares determinados (no sustituyendo) debido a la simetría complicada, la simetría de los sulfatos es menor.
Los que contienen Zn-Cu-Pb(U) son más densos que los que tienen Na(K)-Ca.
Los mas duros son los menos densos, es decir, existe una relación inversa entre densidad y dureza.
Los más densos poseen un índice de refacción mayor. En general, el I.R. con el contenido en Fe aumenta (se observa en la serie Alunita-Jarosita):
Alunita es un sulfato de Fe y K. (KAl3 (SO4)2(OH)6.
Jarosita Fe3.
La Alunita es uniáxica + (w=1.572, ε=1.592), y la Jarosita uniáxica negativa (w=1.820 y ε=1.715).
En general los sulfatos son ópticamente positivos, pero en el caso de los más densos son negativos.
Karobbi distingue cuatro grupos:
1. Sulfatos anhidros.
2. Sulfatos anhidros, pero con aniones adicionales.
3. Sulfatos hidratados.
4. Sulfatos hidratados con aniones adicionales.
1. Sulfatos anhidros:
1.a. Anhidrita ────────> SO4Ca.
1.b. Baritina ────────> SO4Ba.
1.c. Celestina ────────> SO4Sr.
1.d. Anglesita ────────> SO4Pb.
Los cuatro minerales son isoestructurales y cristalizan en el sistema rómbico.
1.a. ANHIDRITA.- Es consecuencia del proceso de deshidratación del yeso sobre 100°C. Su estructura es como la del Zircón, es decir, grupos SO4 coordinados con Ca, en coordinación 8 un poco distorsionada.
Se obtiene por deshidratación del yeso, a 100°C es soluble y a 150°C se convierte en anhidrita hexagonal.
Presenta color violeta o azul. Su hábito es fibroso radiado. La birrenfringencia es alta.
- YACIMIENTOS:
Se forma en condiciones sedimentarias donde es constituyente importante en evaporitas.
Como alteración, también en condiciones sedimentarias, de calizas y dolomías.
Para que se forme en cuenca marina, la temperatura debe ser mayor de 42°C o bien que la concentración en sales sea alta para unas condiciones de temperatura por debajo de los 42°C.
En condiciones hidrotermales, se forma dentro de los pórfidos de Cu.
1.b. BARITINA.- Es el sulfato de Ba, siendo frecuente. Su nombre debe su origen a su elevado peso.
En su estructura, los tetraedros SO4 están coordinados por Ba, pero la coordinación es 12.
Existe una serie isomorfa de Baritina a Celestina, teniendo que si:
El contenido de Sr es mayor que la concentración de Ba, se le denomina Barito-Celestina. [Sr]>[Ba].
Si el contenido de Sr es menor que el de Ba, recibe el nombre de Estroncio-Baritina. [Sr]<[Ba].
Entre el Sulfato de Ba y el Sulfato de Pb la sustitución es más limitada, aunque se han encontrado Baritinas con mucho Pb.
Presenta hábito tabular prismático.
Es incolora a rosa.
Tiene una exfoliación perfecta según (001) para todos los minerales de su grupo.
El I.R. varia según el contenido en Pb. Mayor cuanto más Pb posea y disminuye con el contenido en Sr. Si el contenido en Pb y Sr aumenta, el ángulo 2V también aumenta.
La densidad es de menor a mayor: Sr, Ba, Pb.
- YACIMIENTOS:
En condiciones hidrotermales, yacimientos de tipo filoniano. De temperatura media a baja asociada a Calcita, Fluorita y Q.
En yacimientos de tipo vulcano-sedimentarios. Durante muchos años fue Mehen el principal productor y estaba asociada a Py, Cpy y Esfalerita. En España hay en la provincia de Zamora en Alcañices y en Badajoz (LLerena), en relación con cuenca marina.
1.c. CELESTINA.- Es el sulfato de Estroncio.
Su color es azul.
Es isoestructural con la Baritina.
Presenta cristales prismáticos.
- YACIMIENTOS:
En cuencas lacustres en paragénesis con yesos y anhidrita. En México y Madagascar.
Hidrotermal de temperatura media, en las cavidades de las rocas volcánicas, donde constituye un relleno tardío gracias a la actividad de las soluciones.
En filones asociada a Galena, Blenda y otros sulfuros.
1.d. ANGLESITA.- Es el sulfato de plomo.
Cristaliza en el sistema rómbico.
Los cristales son prismáticos de hábito tabular.
Suele ser incolora, también blanco grises-verdosos.
La introducción de Pb en la red, produce un aumento en el I.R. así como de la densidad, por lo tanto el brillo será adamantino.
- YACIMIENTOS:
Típico como producto de alteración de la Galena en la zona de oxidación de los yacimientos minerales de Pb, asociado a otros minerales como la Ga, Cerusita (esta más frecuente que la Anglesita, ya que las condiciones de acidez de formación de la Anglesita deben ser mayores).
En España aparece en relación con yacimientos de oxidación de Pb. Minas de la Unión.
TENARDITA.- La Tenardita es el sulfato de Na. Cuando aparece cristalizada lo hace en el sistema rómbico bipiramidal. Se encuentra asociada a series evaporíticas.
GLAUBERITA.- Es el otro sulfato sódico que se explota a cielo abierto se recupera el 98% en Tirán. Son muy rentables y en España es el único lugar donde se explota de forma natural. Aparece asociada a Anhidrita. Estos sulfatos sódicos son importantes por ser el único país con sulfato sódico natural.
Dentro de este grupo aparece una serie de minerales asociados a la zona de oxidación-cementación de yacimientos metálicos:
| 2.a. Brocancita ────────> SO4Cu4(OH)6 | │ | |
| │ | Sulfato de Cu. | |
| 2.b. Antlerita ─────────> SO4Cu3(OH)3 | │ | |
| 2.c. Alunita-Jarosita ────> KAl3[(OH)6│(SO4)2] |
2.a. BROCANCITA.- Es el sulfato de Cu. La identificación de visu es muy difícil, distinguiéndose por difracción de rayos X.
- YACIMIENTOS:
Aparece sobre todo en zonas desérticas. En Arizona se encuentra con Azurita y Malaquita.
En pórfidos cupríferos en la zona de Chile y Arizona.
Asociado a la zona de oxidación con Azurita y Malaquita.
2.b. ANTLERITA.- Es el otro sulfato de Cu, con un aspecto igual al anterior. Se encuentra asociado a los mismos yacimientos que la Brocancita.
2.c. GRUPO DE LA ALUNITA-JAROSITA:
Constituye una serie isomorfa que abarca una serie de términos que encajan en la fórmula:
MeI Me3III (SO4)2 (OH); donde
MeI = Puede ser Na ó K.
Me3III = Puede ser Al3+ ó Fe3+
Estos dos metales aparecen en coordinación distinta, el Na ó el K, en coordinación 12, y el Al3+ ó Fe3+ en coordinación 6 (4 O, y dos aniones o grupos OH), es decir, octaédrica.
Componen una serie isomorfa, donde puede existir un rango importante de sustitución isomórfica:
También puede darse una sustitución de uno monovalente por uno divalente, o bien de un grupo sulfato por uno difosfato.
Son importantes porque cuando aparecen suelen existir mineralizaciones.
2.c.1. JAROSITA.- Es un mineral que de visu resulta difícil su identificación porque se parece a la Limonita y Goethita.
Posee interés porque es indicadora de que existen mineralizaciones profundas de Py.
Sirve también como trampa, llenando sobre todo Ag y Sn, a veces Au. En España, comprende toda la zona de Cartagena y la faja pirítica. La Ag va en forma de argentojarositas y Ag nativa.
La alunitización debe casi todo su origen a un ambiente hidrotermal epitermal de metales preciosos, constituyendo zonas interesantes para prospectar.
Dentro de este grupo se incluye el Yeso.
YESO.- Cristaliza en el sistema monoclínico prismático, con tres tipos de celdas:
Presenta una estructura estratificada. Las capas se encuentran unidas por Ca2+ y coordinada por los 6 O2 del grupo SO- y dos O2 del grupo H2O. El H2O se encuentra intercalado entre láminas, por lo que puede perder o ganar moléculas de agua sin necesidad de reestructurarse.
Tiene exfoliación paralela al eje a y al eje c (010). Aparece bien cristalizado, formando maclas, siendo las mas frecuentes en forma de cola de golondrina (100), o bien en forma de punta de flecha (101).
La variedad de yeso que existe en el Alabastro que se utiliza en ornamentación en España se explota en Jadraque (Guadalajara), la Rosa del Desierto (aparece en zonas muy áridas en cristales lenticulares).
Es uno de los pocos minerales que tiene signo óptico positivo. Aparece coloreado.
La curva de deshidratación del Yeso (por la situación de las moléculas puede perderlas):
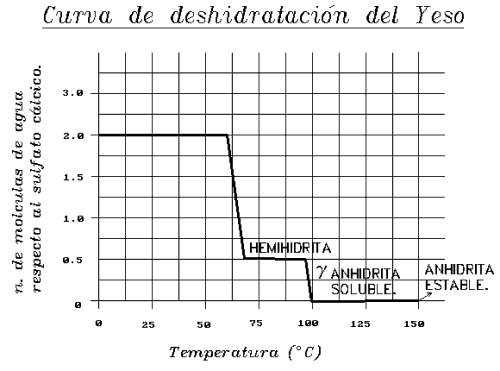
El Yeso es muy importante en España por ser un mineral muy común. Se encuentra asociado a Calcitas, Anhidritas, Dolomías, siendo el primer mineral en depositarse.
Se utiliza en la construcción, para dar consistencia a las pinturas y como abono.
© Mario Izquierdo, 2024 | Aviso legal | Política de Privacidad