
Los compuestos iónicos se forman por iones de distinta carga:
^ ¬
+-+ +-+ +-+ +-+ +-+ +-+ | /
|+| |-| |+| |-| |+| |-| | /
+-+ +-+ +-+ +-+ +-+ +-+ | /
| /
+-+ +-+ +-+ +-+ +-+ +-+ | /
|-| |+| |-| |+| |-| |+| | /
+-+ +-+ +-+ +-+ +-+ +-+ | /
| /
+-+ +-+ +-+ +-+ +-+ +-+ | /
|+| |-| |+| |-| |+| |-| | /
+-+ +-+ +-+ +-+ +-+ +-+ +---------------------------->
- La es completa, los iones no están aislados.
- Se caracterizan porque la electronegatividad de los elementos que lo forman es muy distinta. Ejemplo:
| ClNa |
|
Cl- |
|
Na+ |
Peso fórmula.- Este término se utiliza de la misma forma que molécula en el enlace covalente. Se define como el sumatorio de los pesos atómicos de los elementos que forman el compuesto. Indica la relación de los iones en el compuesto. Ejemplo:
| Pa(Cl) | = | 35.5 |
| Pa(Na) | = | 23.0 |
| ---------------- | ||
| Pa(NaCl) | 58.5 | |
El valor 58.5, indica el peso de la fórmula, es decir, que están en relación 1:1.
Compuestos iónicos:
| a) Sales. Ejemplo: NaCl => | Na+ Cl- |
| b) Oxidos. Ejemplo: FeO => | Fe+2 O-2 |
| c) Sulfuros. Ejemplos: CaS | | S2- |
| ZnS | | Mn+ |
- En el caso del NaCl, existe una relción igual de iones positivos que de iones negativos:
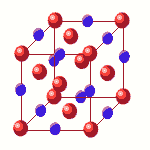 |
|
| Cl; | 8·1/8 + 6·1/2 = 4 | | | La relación es 1:1 |
| Na; | 12·1/4 + 1 = 4 | | |
Energía reticular:
Se define la 'energía reticular' de una sustancia como la energía necesaria para separar totalmente las partículas de un mol de la misma, en estado cristalino. Ejemplo:
| Na+(g) + Cl-(g) --------------> Na+Cl- + Uo=769 Kj/mol |
| 2F- + Ca+2 --------------> F2Ca |
· Formación del compuesto iónico:
La fuerza con que se atraen los iones en la estructura, cumple la ley de Coulomb (en caso de que se aproximen desde el infinito):
| Q+1 | |||
| Fa | = | K· | ---------------- |
| r2 |
También existen otras fuerzas que son las que ejercen los iones del mismo signo. Por tanto, el total de las fuerzas que actúan en la estructura son las 'Fuerzas atractivas' y las 'Fuerzas repulsivas' (estas últimas no son coulombianas). Las 'Fuerzas repulsivas', fueron introducidas por Borh, y vienen determinadas por la fórmula:
| B | ||
| Fr | ------ | |
| rn |
n, depende de la naturaleza del ión, B es el factor de compresibilidad.
· Representación de la Energía Potencial en función de las Fuerzas Atractivas y las Fuerzas Repulsivas:
Tenemos que intervienen los siguientes parámetros: do que es la distancia de equilibrio, el lugar donde Er es igual a Ea, que es la energía reticular. U0 es la energía reticular:
| Z+ ⋅ e- · Z- · e- | B | |||
| U0 = Ea + Er = | N | ----------------------------------- | + | ------- |
| d0 | dB |
Z · e-, es el número que expresa la carga del ión. Ejemplo: Ca+2 sería 2·(carga del e-). Tenemos que n = r.
| * |
|
'A', es la constante de Madelung, y refleja las proporciones de atracción de cada ión con respecto a los otros.
'*', es el valor de la energía reticular (del modo inverso al antes definido, la energía reticular de una sustancia es la energía que se desprende al formarse un mol de dicha sustancia cristalina).
Ciclo de Borh-Haber (Energía reticular):
Los procesos de formación de iones Na+ y Cl-, partiendo de Na metálico y de Cl2 gaseoso, son los siguientes:
1. En primer lugar se debe pasar el Na(s) a Na(g), comunicándole una 'energía de sublimación':
| Na(s) + ΔHg -----------------> Na(g) ΔHh = 107.5 Kj/mol |
2. Después para ionizarlo, se le comunica una 'energía de ionización':
| Na(g) + ΔHF.I. -----------------> Na+(g) + e- ΔHF.I. = 493.7 Kj/mol |
3. A continuación, se necesita disociar el Cl, para ello se le comunicará una 'energía de disociación':
| ½Cl2 + ΔHD ---------------> Cl(g) ΔHD = 121.3 Kj/mol |
4. Después se convertirá en ión, y desprenderá 'energía de afinidad electrónica':
| Cl(g) + e- -----------------> Cl-(g) + ΔHA.E. = 364.5 Kj/mol |
| El balance final del calor de formación es: |
| ΔHF = ½ΔHD + ΔHH.E. + ΔHg + ΔHP.I. + ΔHUo |
A partir de esta expresión se puede deducir ΔHUo, ya que se conocen los demás datos.
Existe una pequeña diferencia entre ΔHUo, y el valor obtenido por la fórmula (*). Esta diferencia significa que el enlace no es 100% iónico, sino que puede existir una presencia de otras fuerza de enlace, como fuerzas de Van der Waals, covalentes, etc. Como ejemplo se puede citar el ZnS.
La forma de cristalización de estos compuestos no suele ser aleatoria, sino que siguen unas pautas:
· Cada ión se rodea del máximo número posible de iones de signo contrario. Teniendo en cuenta el tamaño del ión, etc.
Con esta condición, se tienen las estructuras tipo:
| | | CsCl | |||
| | | NaCl | |||
| - Tipo MX | | | ZnS (Blenda) | | | Depende de la disposición interna. |
| | | ZnS (Wurtzita) | | |
| | | F2Ca | |||
| - Tipo MX2 | | | TiO (Rutilo) | ||
| | | SiO2 (Cristobalita) |
· Los compuestos que cristalizan de la misma forma se denominan 'isomorfos'.
· Se entiende por número de coordinación, al número de iones de signo contrario que rodea a otro ión de distinto signo. Por ejemplo, si a un ión le rodean 4 aniones, , y cada uno de estos cuatro cationes, su número de coordinación es 4, y la relación es 4:4.
Estructuras tipo MX:
· Cloruro de Cesio (CsCl):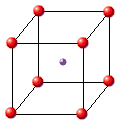 |
|
· Cloruro Sódico (NaCl): |
|
- Cuando pertenecen al tipo MX, debe existir el mismo número de iones de un signo que del signo contrario.
· Sulfuro de Cinc, sistema cúbico (ZnS, Blenda):
|
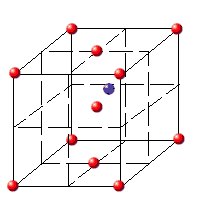 |
Empaquetamiento de iones sulfuro que ocupan la mitad de los huecos tetraédricos que generan.
· Sulfuro de Cinc, sistema hexagonal (ZnS, Wurtzita):
Tenemos que al empaquetarse entre la 1ª y la segunda planta, existe un hueco tetraédrico, pero en el caso de la Wurtzita es de coordinación 6:
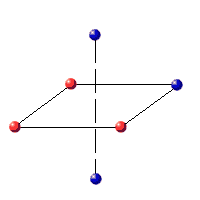 |
| Si se comparcta siempre: |
| n -----------> 2n (tetraédricos) ------------> n (octaédricos) |
Si la 3ª capa ocupa la misma posición que la 1ª, da otra posición: ABC ABC ABC ABC ABC .............., es cúbica.
Si la distribución es del tipo: AB AB AB AB AB .............., es hexagonal.
Blenda.- Empaquetamiento de iones sulfuro que ocupan la mitad de los huecos tetraédricos que generan.
Wurtzita.- Igual que la blenda pero hexagonal.
- Diferencias y semejanzas entre algunos compuestos iónicos:
Estructuras tipo MX2:
· F2Ca (F- Ca+2; 2F- Ca+2). Es casi derivada de la estructura compacta, pero no exactamente. Los vértices y el centro de las caras se encuentran ocupadas por Ca; los F- se encuentran en el centro de cada cubo que resulta al dividir un cubo superior en ocho cubos. Su coordinación en 4:8.
· TiO2 (Rutilo). La estructura es una red cúbica distorsionada tetragonal. Los iones que lo forman son Ti+4 y O-2. Su número de coordinación es 6(Ti):3(O). No es una estructura compacta. Los oxígenos se sitúan más o menos a un tercio entre vértices:
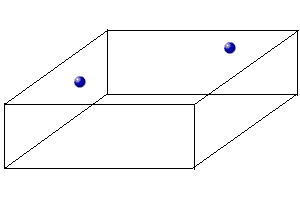 |
 Oxígeno Oxígeno |
· Β-Cristobalita (SiO2). Su coordinación es 4:2.
| Láminas | Cadenas | Moléculas | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
|
Se remite a localizar el ión en una estructura determinada. En un ión aislado no tiene mucho sentido hablar de radio iónico, ya que, por ejemplo en el I-, la probabilidad de encontrar la posición del e- es un valor muy pequeño. Por el contrario en un compuesto iónico:
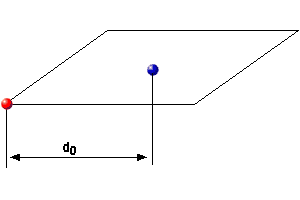 |
d0 = rc + ra |
· Los aniones, por regla general poseen mayor radio iónico que los cationes, así como mayor tamaño. Ejemplo:
| Si-4 = 2.71Å | Si+4 = 0.41Å |
· Para un mismo elemento, al aumentar su carga positiva o estado de oxidación, el tamaño del radio iónico disminuye:
| Ti+2 | 0.86 | ^ | ||
| Ti+3 | 0.67 | | | r | |
| Ti+4 | 0.61 | | |
· Dentro de los elementos de un mismo grupo, siempre que posean la misma carga, el radio aumenta al aumentar el número cuántico principal:
| | | Li+ | 0.60Å | | | F- | 1.36Å | |||
| | | Na+ | 0.95Å | | | Cl- | 1.81Å | |||
| n | | | K+ | 1.33Å | n | | | Br- | 1.95Å | |
| | | Rb+ | 1.48Å | | | I- | 2.16Å | |||
| v | Cs+ | 1.69Å | v |
· Para iones de grupos distintos pero con la misma configuración electrónica externa (isoeléctricos), el radio es mayor en iones negativos que en iones positivos; disminuye a medida que aumenta la carga positiva:
| C-4 | N-3 | O-2 | F-[Ne] | Na+ | 2s22p6 |
| 2.6 | 1.71 | 1.4 | 1.36 | 0.95 |
· Conociendo el radio iónico, se pueden conocer las características de sus estructuras. Que pueden ser:
a) Su forma de cristalización va a depender de la relación rc/ra. De esta manera conocemos el hueco existente entre los iones:
| CsCl | 8:8 | rc/ra = 0.732, | si la relación es mayor o igual cristalizará en forma CsCl. |
| NaCl | 6:6 | rc/ra = 0.414 | si está comprendido en [0.414,0.732), cristalizará en NaCl. |
| ZnS | 4:4 | rc/ra = 0.225 | si está en el intervalo [0.225,0.414), cristalizará en estructura ZnS. |
| ^ | |
| | | CsCl(8) |
| | | |
| 0.732 | |
| ^ | |
| | | |
| | | NaCl(6) |
| | | |
| 0.414 | |
| ^ | |
| | | ZnS(4) |
| | |
b) En la energía reticular influyen porque:
| Z+ · e- · Z- · e- · A · N | |||
| U0 | = | --------------------------------- | (1 - 1/n) |
| d0 · 4 π E0 |
Siendo:
· Si la energía reticular es alta, el carácter iónico será también mayor.
· Los compuestos de mayor energía reticular, los dan los de mayor carga y menor radio iónico.
Sus propiedades están relacionadas con la energía reticular, de forma que cuanto mayor sea su U0, mayor será su carácter iónico. Una energía reticular elevada, implica un aumento en la dificultad para romper la red, por tanto, en los compuestos iónicos, el punto de ebullición y fución son altos, lo que les hace útiles en la industria de refractarios.
A continuación aparecen algunos ejemplos de puntos de ebullición y fusión:
| NaF | NaCl | NaBr | NaI | |
| T° | 988°C | 800°C | 790°C | 660°C |
| rI | 2.31Å | 2.81Å | 2.89Å | 3.23Å |
Los compuestos iónicos se caracterizan por tener un bajo coeficiente de dilatación térmico:
| ΔV | ||
| dt | = | ------ |
| C° |
Son sólidos no conductores debido a que los iones se desplazan muy poco o nada. Ligeramente conductores en estado fundido. En algunos casos conductividad superiónica, que es como si se movieran los iones en la red. Pero por regla general no son conductores.
Son solubles en disolventes polares.
© Mario Izquierdo, 2024 | Aviso legal | Política de Privacidad