
* Características generales de los carbonatos:
Existen 80 minerales conocidos pero poco abundantes, sólo unos pocos se han estudiado. Todos poseen el grupo CO-, con 3 O en los vértices y el C situado en el centro del triángulo. Todos los grupos se engloban en tres series:
| • Calcita. | │ | |
| │ | Trigonal | |
| • Dolomita. | │ |
| • Aragonito. | │ | Ortorrómbico |
• Carbonatos monoclínicos con grupos OH.
Entre los carbonatos trigonales (grupo de la Calcita) y los ortorrómbicos (grupo el Aragonito), se encuentra uno intermedio el Carbonato Cálcico.
El carbono se encuentra como C4+, configuración triangular con el Ox. La valencia electrostática del enlace C-O, es la carga del C=4 dividido por la coordinación del C con el Ox que es 3:
C=4 O=3 => 4/3 = 1 + 1/3
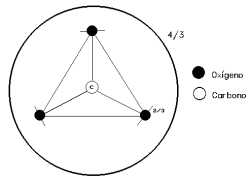
A cada O para enlazarse le quedan 2/3 de su valencia electrostática, por tanto va a ser mas fuerte el enlace C-O que es de tipo covalente, que el iónico que se dará ente el O y otro catión de la estructura.
Los carbonatos son constituyentes principales de calizas dolomías, estructuras de seres vivos, rocas metamórficas como los mármoles calcíticos y dolomíticas de rocas ígneas llamadas carbonátitas. Son comunes en venas hidrotermales y zonas de reemplazamiento.
La relación de radios Ca:O es de 0.707, esta relación se encuentra próxima a la coordinación 6 y 9 (0.732), entonces unas veces presentará coordinación 6 (en el grupo de la calcita => trigonales) y otras 9 (estructura tipo Aragonito => ortorrómbicos).
El radio del Ca=0.99, por lo que cualquier carbonato con un catión de radio inferior al del Ca produce una estructura tipo Calcita. Sin embargo, si es mayor, es tipo Aragonito, encontrándose el límite en el Carbonato Cálcico.
| │ | │ | │ | |||
| Calcita (Ca) 0.99 | │ | │ | │ | ||
| Otavita (Cd) 0.79 | │ | Isoestructurales | │ | Soluciones | │ |
| Rodocrosita (Mn) 0.80 | │ | Isoestructurales | │ | sólidas | │ |
| Siderita (Fe) 0.74 | │ | con la Calcita | │ | completas | │ |
| Esferocobaltita (Co) 0.72 | │ | │ | entre ellas | │ | |
| Smithsonita (Zn) 0.74 | │ | │ | │ | ||
| Magnesita (Mg) 0.60 | │ | │ | │ |
NO se da polimorfismo, solo se da en la Calcita.
| Aragonito (Ca) 0.99 | │ | Las soluciones sólidas |
| Cerusita (PbCO3) 1.20 | │ | |
| Witherita (BaCO3) 1.34 | │ | no van a ser completas |
| Estroncianita (SrCo3) 1.34 | │ |
Si la diferencia de radios es mayor del 15% (la diferencia de radios no puede exceder el 15%) no forman solución sólida completa.
Existen otros 6 polimorfos de la Calcita menos conocidos, de los cuales, solo uno se da en medios naturales:
- Vaterita ──────── Hexagonal.
Los demás son sintéticos.
Ambientes sedimentarios: calizas y dolomías (Calcita y Dolomita).
En las conchas recientes de moluscos (los recientes son de Aragonito y los fósiles son de Calcita); equinodermos y algas.
Como cemento en conglomerados y pudingas.
En rocas metamórficas. Mármoles formados como consecuencia de un metamorfismo regional o de contacto.
Existe una reacción importante para que funcione como termómetro geológico, entonces si existe Q en el medio el CaCO3 forma CaSiO3 (Wollastonita):
CaCO3 + SiO2 ------> CaSiO3 + CO2
La Calcita aparece en rocas metamórficas asociada a Diópsido, Tremolitas, Granates y Forsteritas.
También los carbonatos aparecen en venas hidrotermales, en rocas ígneas (carbonatitas),
En procesos metasomáticos y de alteración. En el caso de alteración se produce Magnesita, como consecuencia de la alteración de rocas ígneas metamórficas ricas en Mg.
La Calcita es trigonal, y los Ca2+ se encuentran coordinados por 6 O2. La estructura de la Calcita es similar a la de la Halita, sólo que variando los Na por los Ca, y en las posiciones de Cl se encuentran los C. El enlace va a ser covalente entre el O y el C, e iónico entre el O y otro catión de la estructura.
Si comprimimos una celda de Halita en la diagonal, en un 76.66%, quedando un ángulo entre a y b de 101.55°, obtendremos el romboedro de exfoliación de la Calcita. La simetría que se va a conservar en la nueva celda es:
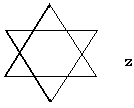
Los centros de simetría en el cúbico se conservan en el Ca, pero en el C no porque son carbonatos. Los grupos carbonato adoptan dos posiciones opuestas, lo que produce que la birrefringencia sea alta en la Calcita. El resto de la simetría se pierde.
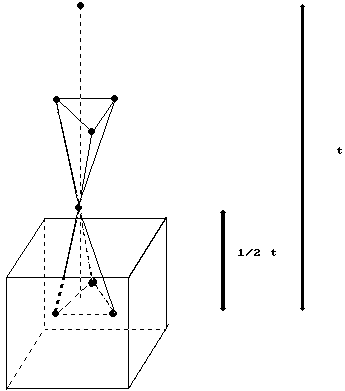
En este romboedro de exfoliación los grupos carbonato se disponen en planos perpendiculares al eje c (ternario). Tiene 2 CaCO3 por celda unidad. Para evitarlo se utiliza el romboedro de exfoliación agudo, en el que la diagonal mayor es el eje c de la celda, teniendo las mismas dimensiones que el romboedro de exfoliación. Así, el número de fórmulas es de 2. El poliedro de coordinación del Ca con el C está muy deformado en la dirección de la diagonal, el del Ca con el Ox es casi regular, algo achatado en la dirección de acortamiento. La exfoliación romboédrica según (100) en la Calcita, es igual que en la Halita.
Presenta 3 hábitos importantes:
Es muy corriente la macla con el plano de macla {012}, a) y maclas según el pinacoide básico {0001} como plano de macla b). También en masas granuladas finas a compactas, terrosas y en forma estalactítica.
El color es generalmente blanco a incoloro, pero puede tener diversos tonos, en caso de contener cationes, grisáceo, rojizo, verdoso, azulado y amarillento. Si es impura, de pardo a negra.
Puede ir de transparente a translúcida. La variedad químicamente pura e incolora, se conoce con el nombre de Espato de Islandia, y presenta la doble refracción.
Se distingue de otros carbonatos porque frente al HCl diluido, presenta efervescencia en frío, así como por difracción de Rayos X (R.X).
La mayor parte de las Calcitas tienen una composición relativamente próxima al CaCO3 puro, pudiendo contener menos de un 6% de Magnesita y un 10% de Siderita, por tanto no presenta soluciones sólidas completas.
Ambientes exógenos:
Ambiente hidrotermal:
- UTILIZACIÓN:
En la fabricación del cemento Portland. Compuesto por un 75% de CaCO3, siendo el resto esencialmente sílice y alúmina. También pequeñas cantidades de carbonato magnésico y óxido de Fe.
Como fundentes en la extracción de diversas menas metálicas.
Como piedra ornamental.
La variedad Espato de Islandia, se utiliza en la fabricación de instrumentos ópticos.
MAGNESITA:
Es el carbonato de Mg.
Cristaliza en el sistema hexagonal.
Rara vez en cristales ortorrómbicos. Normalmente en masas criptocristalinas blancas a amarillentas (en función del contenido en Fe), compactas y terrosas; menos frecuente en masas granulares exfoliables, bastas o finas.
Su color oscila entre blanco y amarillo, en función del la cantidad de Fe que tenga.
Existe solución sólida completa entre Magnesita y Siderita, es decir, que el Fe puede sustituir al Mg.
Existe un mineral denominado Breumerita ((CO3)2), que posee una composición que está entre Magnesita y Siderita.
Hay solución sólida completa con la Calcita, admite menos del 5% de Ca en su estructura.
- YACIMIENTOS:
Filones derivados de la alteración de rocas ígneas y metamórficas con alto contenido en Mg, (peridotitas y serpentinas) por la acción de aguas carbonáticas sobre ellas.
Por la acción de fluidos ricos en Mg sobre calizas (Ca --> Mg). Destaca en Engui (Navarra), donde la Magnesita aparece encajada en Dolomita, en forma de lentejones. La Dolomita es carbonato de Ca y Mg. En Engui, la Dolomita presenta textura en empalizada, que es consecuencia de la presencia de materia orgánica en capas.
En depósitos evaporíticos (bien cristalizados).
- EMPLEO:
Magnesita calcinada, MgO, es decir la calcinada a alta temperatura y que contiene menos del 1% de CO2, se utiliza en la fabricación de ladrillos refractarios para hornos.
Como fuente de magnesia para productos químicos industriales.
Fue empleada como mena para la obtención del Mg metálico, pero actualmente todo el Mg producido se obtiene de soluciones saladas y agua del mar.
SIDERITA:
Es el carbonato de Fe (FeCO3).
Los cristales son generalmente romboedros, frecuentemente con caras curvas. También en concrecciones globulares. Generalmente granular exfoliable. Pudiendo ser también botroidal, compacto y terroso.
Su color es de castaño oscuro a claro. Transparente a translúcido. Se distingue de otros carbonatos por color y gran peso específico, y de la Blenda por su exfoliación romboédrica.
Se vuelve fuertemente magnético al ser calentado.
- YACIMIENTOS:
Se encuentra en ambientes sedimentarios reductores, como en cuencas hulleras. Como hierro litoide contaminado con materiales carbonosos, en formaciones estratiformes extensas en esquistos y normalmente asociada a yacimientos de carbón. Aparece en dos formas: capas y nódulos.
Como consecuencia de la acción de soluciones ferrosas sobre las calizas, si los depósitos son extensos, pueden tener valor económico.
En su forma cristalizada, es un mineral filoniano comúnmente asociado con varias menas metálicas, tales como minerales de Ag, Py, Cpy, Tetraedrita y Galena.
RODOCROSITA:
Es el carbonato de Mn (MnCO3).
Raramente aparece en cristales, generalmente en masas exfoliables; granular a compacta. El color posee una tonalidad de rosada a roja.
Existe solución sólida completa entre la Siderita y Rodocrosita (Fe y Mn). No entre Magnesita y Rodocrosita, la proporción de Ca que puede sustituir al Mn es pequeña.
- YACIMIENTOS:
Se encuentra en un tipo de Pegmatitas.
En filones hidrotermales con menas de Ag, Pb y Cu, y con otros minerales de Mn.
- EMPLEO:
Como mena secundaria de Mn.
Pequeñas aplicaciones con fines ornamentales.
SMITHSONITA:
Es el carbonato de Zn (ZnCO3).
Raras veces en cristales, siendo más común reniforme, botroidal o estalactítico y en incrustaciones cristalinas o en masas aplanadas, conocidas como calaminas.
Su color es generalmente pardo sucio, pudiéndose ser incoloro, blanquecino, verdoso, azulado o rosado. La variedad amarillenta contiene Cd.
Su composición es distinta de los carbonatos, con la posibilidad de contener Fe no en solución sólida, sino en un porcentaje pequeño:
La Smithsonita es isoestructural con la Calcita.
- YACIMIENTOS:
Es mena de Zn de origen supergénico, se encuentra generalmente con los depósitos de Zn en calizas.
Asociada a Blenda, Galena, Hemimorfita, Cerusita, Calcita y Limonita.
En España está el yacimiento de Reocín (Santander), donde está asociada a calizas, en la zona de oxidación de Esfaleritas y Lepidolitas.
- EMPLEO:
Como mena de Zn.
Una pequeña parte en ornamentación.
Se compone de:
Dolomita ---> (CO3)2CaMg.
• Ankerita ---> (CO3)2CaFe.
• Kutnahorita ---> (CO3)2CaMn.
DOLOMITA: Estructura
La estructura de la Dolomita es igual que la de la Calcita, en este caso sustituyendo en planos alternos el Ca por Mg.
El enlace que existe entre Ca y Mg es iónico.
Las características son análogas a las de la Calcita, así como los parámetros de red. El radio atómico del Mg es mayor y el radio de enlace es menor, lo que supone que el eje c sea menor.
La exfoliación es la misma que en la Calcita (101).
Su estructura está perfectamente ordenada, con lo que el Ca y Mg tiene sus posiciones fijas, por tanto no existe solución sólida completa.
Todos los minerales del grupo presentan un grupo espacial, es r.
Los Ca no son equivalentes, por lo tanto están en capas alternas.
El eje ternario permanece, pero no es así con el binario y los planos de simetría.
Los hábitos que presenta están formados generalmente por:
Frecuentemente maclado según {0001} plano perpendicular al eje c.
Generalmente presenta coloraciones rosadas; puede ser incoloro, blanquecino, grisáceo, verdoso, pardo o negruzco.
Presenta solución sólida completa con la Ankerita (Mg ---> Fe).
- YACIMIENTOS:
Principalmente en masas rocosas extensas formando las calizas dolomíticas y su equivalente metamórfico, el mármol dolomítico.
La Dolomita, como roca, se piensa que no es de origen secundario, por transformación de la caliza ordinaria por reemplazamiento del Ca por Mg. El reemplazamiento puede ser parcial y así, la mayor parte de las rocas dolomíticas, son mezcla de Dolomita y Calcita.
Como mineral filoniano, sobre todo en filones de Pb y Zn que atraviesan la caliza, asociado a Fluorita, Calcita, Baritina y Siderita.
- EMPLEO:
Como piedra de edificación y ornamentación.
En determinados cementos.
Para la fabricación de magnesia, que se usa en la preparación de revestimientos refractarios de los convertidores en los procesos básicos de obtención del acero.
Es mena potencial de Mg metálico.
Los minerales que integran esta serie poseen metales divalentes, cuyos radios son mayores de 1. Pertenecen al sistema rómbico. Son isoestructurales.
Presentan todos una estructura estratificada. Poseen un grupo espacial Pmcn. Muestran una variación con respecto a la Calcita, y es que en el Aragonito se produce un desdoblamiento de capas en las que se sitúan los grupos CO3.
Los grupos CO3 aparecen girados 30° a derecha e izquierda, unos con respecto a los otros.
El desdoblamiento de los giros producen huecos mayores, donde pueden situarse cationes mayores. Los cationes más pequeños, que tienen 0.99Å de radio, no serían estables en esta estructura.
El poliedro de coordinación está unido a 9 O2 de los grupos CO3. Tres de estos 6 grupos CO3 están ligados al Ca por 2 de sus O2 y los otros 3 CO3 sólo por un O2. El poliedro resultante está muy deformado.
A pesar de que los grupos CO3 se encuentran a 2 niveles, se mantiene la estructura estratificada. Debido a esto, estos minerales tienen signo óptico negativo, birrefringencia alta, y 2 de los 3 índices de refracción muy altos y el tercero bajo.
La composición real del Aragonito es muy similar a la teórica. Existen pocas sustituciones, menos la del Ca por el Sr que es una sustitución continua.
- Transformación Calcita-Aragonito:
Consiste en una transformación de tipo reconstructivo. Afectando a la primera esfera de coordinación. Se pasa de una coordinación 9 (para el Aragonito), a una coordinación 6 (para la Calcita). Es una transformación lenta.
El Aragonito es estable a una presión mayor y temperatura menor.
La Calcita es estable a una presión menor y temperatura más alta.
El Aragonito, en condiciones ambientales no es estable, transformándose a Calcita.
Variaciones en la curva del campo de estabilidad:
- Si hay Mg: aumenta el campo de estabilidad de la Calcita. Cuantas más imperfecciones hay en la Calcita más fácil resulta la transformación.
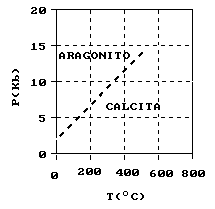
Localización aproximada de los campos de estabilidad determinada experimentalmente en la Calcita y el Aragonito.
ARAGONITO:
Presenta 3 hábitos:
- YACIMIENTOS:
En condiciones sedimentarias:
Es mas raro que la Calcita. Es necesaria la presencia de aguas con alto contenido en NaCl, por lo que el Aragonito es frecuente en las margas del Trias salino de Molina de Aragón.
Precipita en las fuentes termales.
En lavas volcánicas (como producto de alteración).
Estos minerales son típicos de yacimientos hidrotermales, generalmente aparecen en forma de ganga.
Existe una solución sólida completa entre el Ba y el Sr (en menor proporción) que depende de la temperatura.
El catión de mayor tamaño se encuentra en la Cerusita (Pb). Esta presenta una densidad muy alta y un brillo resinoso.
Puede aparecer maclada. Estas maclas son de 3 individuos, que se unen dando una forma hexagonal, mientras que las de Cerusita dan maclas en estrella.
- YACIMIENTOS:
En condiciones hidrotermales se presenta asociada a Galena.
En zonas de alteración de yacimientos de Galena.
Son carbonatos básicos de metales calcófilos. Además de Cu, Zn, Pb, Bi presentan aniones con grupos OH, Cl y grupos sulfatos. Son típicos de la zona de oxidación de yacimientos de Cu (pórfidos).
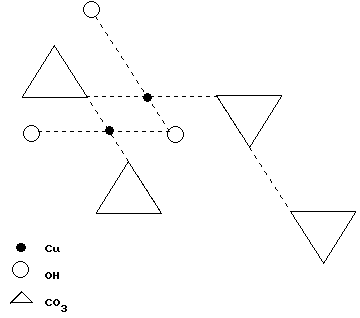
AZURITA:
Su fórmula química es: (CO3)2 (OH)2 Cu3.
Es monoclínica.
El Cu presenta 2 posiciones no equivalentes:
Forman cadenas.
Es de color azul.
- YACIMIENTOS:
Es típico de las zonas de oxidación de yacimientos de Cu (pórfidos). Su paragénesis es: Malaquita, Cuprita, Calcosina, Limonita, etc.
MALAQUITA:
Su fórmula química es [(CO3)│(OH)2] Cu2.
Es monoclínica.
Su estructura es un octaedro distorsionado:
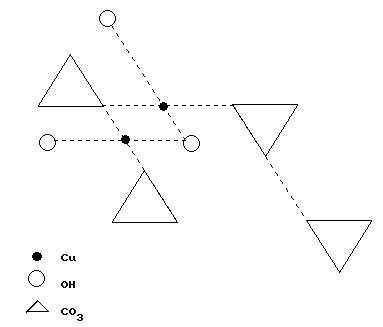
- El Cu:
1. Unido a 2OH y 2O2 de los grupos CO3.
2. Unido a 4O2 de los CO3 y a 2OH.
El campo de estabilidad de la Malaquita es mucho mayor que el de la Azurita. La Malaquita se forma en condiciones menos extremas. Paragénesis: Cu, Cuprita, Cpy y Azurita.
© Mario Izquierdo, 2024 | Aviso legal | Política de Privacidad